Ведущие страны мира по выращиванию пшеницы. Развитие зерновой отрасли в мире
Осмий
О́СМИЙ -я; м. Химический элемент (Os), твёрдый металл голубовато-белого цвета (входит как компонент в состав сверхтвёрдых и износостойких сплавов).
о́смий(лат. Osmium), Os, химический элемент VIII группы периодической системы, относится к платиновым металлам. Название от греч. osmē - запах, по резко пахнущему оксиду OsO 4 . Плотность 22,61 г/см 3 , t пл 3027°C. Катализатор многих реакций, компонент сверхтвёрдых и износостойких сплавов с иридием.
ОСМИЙО́СМИЙ (лат. Osmium), Os (читается «осмий»), химический элемент с атомным номером 76, атомная масса 190,2.
В природе семь стабильных изотопов 184 Os (0,018%), 186 Os (1,59%), 187 Os (1,64%), 188 Os (13,3%), 189 Os (16,1%), 190 Os (26,4%) и 192 Os (41,1%). Конфигурация внешнего и предвнешнего электронного слоя 5s 2 p 6 5d 6 6s 2 . Степени окисления +4, +6, +8 (наиболее характерны), +1, +3, +5 (валентности I, III, IV, V, VI, VIII). Принадлежит к платиновым металлам. (см.
ПЛАТИНОВЫЕ МЕТАЛЛЫ)
Расположен в VIII группе периодической системы элементов, в подгруппе железа, в 6-м периоде. Радиус атома 0,135 нм, ионный радиус иона Os 4+ - 0,077 (координационное число 6), Os 5+ - 0,072 (6), Os 6+ - 0,069 (6), Os 7+ - 0.067 (6), Os 8+ - 0,053 нм (4). Энергии последовательной ионизации 8,5, 17 и 25 эВ. Электроотрицательность по Полингу (см.
ПОЛИНГ Лайнус)
2,1.
Осмий - тяжелый серебристо-белый металл.
История открытия
Открыт в 1804 английским химиком С.
Теннантом (см.
ТЕННАНТ Смитсон)
в черном порошке, остающемся после растворения платины (см.
ПЛАТИНА)
в царской водке (см.
ЦАРСКАЯ ВОДКА)
. Для осмия характерно образование тетраоксида OsO 4 с резким запахом. Отсюда и название элемента, происходящее от греческого «осме» - запах.
Нахождение в природе
Осмий - очень редкий элемент, содержание в земной коре 5·10 –6 % по массе. Встречается в природе в полиметаллических рудах, содержащих также платину (см.
ПЛАТИНА)
и палладий (см.
ПАЛЛАДИЙ (химический элемент))
(сульфидные медно-никелевые и медно-молибденовые руды). Основные минералы - природные сплавы осмия с иридием (невьянскит (см.
ОСМИСТЫЙ ИРИДИЙ)
, сысертскит) и платиной. Встречается в виде соединений с серой (см.
СЕРА)
и мышьяком (см.
МЫШЬЯК)
(эрлихманит, осмиевый лаурит, осарситт). В качестве изоморфной примеси входит в состав халькопирита (см.
ХАЛЬКОПИРИТ)
,
пирротина (см.
ПИРРОТИН)
, пентландита, (см.
ПЕНТЛАНДИТ)
кубанита, магнетита (см.
МАГНЕТИТ)
. Обычно содержание осмия в рудах не превышает 1·10 –3 %.
Получение
Процесс выделения и разделения платиновых металлов, приводящий к разделению этих металлов и получению осмия, описан в статье иридий (см.
ИРИДИЙ)
. Другой способ выделения осмия их обогащенного сырья - прокаливание концентрата платиновых металлов на воздухе при температурах порядка 800-900°C. При этом сублимируют пары OsO 4 , которые далее поглощают раствором NaOH.
Упариванием раствора выделяют соль - перосмат натрия, который далее восстанавливают водородом при 120°C до осмия:
Na 2 + 3H 2 = 2NaOH + Os + 4H 2 O.
Осмий при этом получается в виде губки.
Физические и химические свойства
Осмий - тяжелый серебристо-белый металл (плотность при 20°C 22,65 г/см 3). Решетка гесагональная, типа Mg, а
= 0,27353 нм, с
= 0,43191 нм. Температура плавления 3027°C, кипения 5027°C. При температуре ниже 0,66 К осмий переходит в сверхпроводящее состояние. Металлический осмий парамагнетик (см.
ПАРАМАГНЕТИК)
. В ряду стандартных потенциалов стоит правее водорода (см.
ВОДОРОД)
, с неокисляющими кислотами и водой не реагирует.
Химическая активность осмия зависит от его состояния. Компактный осмий начинает окисляться на воздухе при температурах выше 400°C, а тонкий порошок осмия медленно окисляется до OsO 4 уже при комнатной температуре.
Компактный осмий не растворяется в горячей соляной кислоте и кипящей царской водке (см.
ЦАРСКАЯ ВОДКА)
, а мелко раздробленный осмий окисляется в азотной кислоте и кипящей серной кислоте до высшего оксида:
Os + 8HNO 3 = OsO 4 + 4H 2 O + 8NO 2
При нагревании осмий реагирует со фтором (см.
ФТОР)
,
хлором (см.
ХЛОР)
,
кислородом (см.
КИСЛОРОД)
, серой (см.
СЕРА)
, другими халькогенами (см.
ХАЛЬКОГЕНЫ)
и неметаллами.
Os + 3F 2 = OsF 6 (при 250–300°C),
Os + Cl 2 = OsCl 4 (при 650–700°C).
При сплавлении в присутствии окислителей осмий реагирует со щелочами. При этом образуются осматы (VI) - соли неустойчивой осмиевой кислоты H 2 OsO 4:
2Os + 4NaOH + 3O 2 = 2Na 2 OsO 4 + 2H 2 O
Для осмия наиболее характерно образование оксидов OsO 4 и OsO 2 . В газовой фазе существуют оксиды OsO и OsO 3 .
Тетраоксид осмия OsO 4 проявляет кислотные свойства и является сильным окислителем.
OsO 4 + NaOH = Na 2 .
Диоксид осмия OsO 2 получают аккуратным обезвоживанием в атмосфере азота Os(OH) 4 . При этом образуется черная модификация OsO 2 . Она реакционноспособнее коричневой модификации OsO 2 , получаемой электровосстановлением щелочного раствора OsO 4 или реакцией осмия с OsO 4:
Os + OsO 4 = 2OsO 2 .
Гидроксид осмия(IV) Os(OH) 4 (OsO 2 ·2H 2 O) получают восстановлением солей осмия (VI) - осматов этиловым спиртом.
Для степеней окисления осмия 0 и +2 наиболее характерно образование осмийорганических соединений со связью Os-C или карбонилов:
Os + 5CO = Os(CO) 5 .
3Os(CO) 5 = Os 3 (CO) 12 + 3CO
Os 3 (CO) 12 + 6Na = 3Na 2 Os(CO) 4 .
Применение
Осмий - компонент сверхтвердых и износостойких сплавов с иридием (детали особо точных приборов, прецизионно малые контакты), с иридием и рутением (перья для авторучек), с вольфрамом и молибденом (катоды термоионных диодов), компонент композиционного материала (электрические контакты). OsO 4 используется для окраски биологических препаратов.
Физиологическое действие
Соединения осмия, особенно легколетучие, сильно ядовиты. Тетраоксид OsO 4 раздражает слизистые, поражает органы дыхания. ПДК в воздухе 0,002 мг/м 3 .
Энциклопедический словарь . 2009 .
Синонимы :Смотреть что такое "осмий" в других словарях:
осмий - осмий, я … Русский орфографический словарь
- (греч., от osme запах, от ozo обоняю). Металл, из группы платиновых, голубовато белого цвета, горюч, очень тверд и хрупок, встречается редко. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ОСМИЙ греч., от osme,… … Словарь иностранных слов русского языка
- (символ Os), бело голубой ПЕРЕХОДНЫЙ ЭЛЕМЕНТ, металл, открытый в 1803 г. Будучи самым плотным элементом, осмий встречается в соединениях с платиной. Получают его главным образом как побочный продукт при плавке никеля. Как и ИРИДИЙ, осмий… … Научно-технический энциклопедический словарь
Если с точки зрения практики элемент №76 среди прочих платиновых металлов выглядит достаточно заурядно, то с точки зрения классической химии (подчеркиваем, классической неорганической химии, а не химии комплексных соединений) этот элемент весьма знаменателен.
Прежде всего, для него, в отличие от большинства элементов VIII группы, характерна валентность 8+, и он образует с кислородом устойчивую четырехокись OsO 4 . Это своеобразное соединение, и, видимо, не случайно элемент №76 получил название, в основу которого положено одно из характерных свойств его четырехокиси.
Осмий обнаруживают по запаху
Подобное утверждение может показаться парадоксальным: ведь речь идет не о галогене, а о платиновом металле...
История открытия четырех из пяти платиноидов связана с именами двух английских ученых, двух современников. Уильям Волластон в 1803...1804 гг. открыл палладий и родий, а другой англичанин, Смитсон Теннант (1761...1815), в 1804 г. – иридий и осмий. Но если Волластон оба «свои» элемента нашел в той части сырой платины, которая растворялась в царской водке, то Теннанту повезло при работе с нерастворимым остатком: как оказалось, он представлял собой естественный природный сплав иридия с осмием.
Тот же остаток исследовали и три известных французских химика – Колле-Дескоти, Фуркруа и Воклен. Они начали свои исследования даже раньше Теннанта. Как и он, они наблюдали выделение черного дыма при растворении сырой платины. Как и он, они, сплавив нерастворимый остаток с едким кали, сумели получить соединения, которые все-таки удавалось растворить. Фуркруа и Воклен были настолько убеждены, что в нерастворимом остатке сырой платины есть новый элемент, что заранее дали ему имя – птен – от греческого πτηνος – крылатый. Но только Теннанту удалось разделить этот остаток и доказать существование двух новых элементов – иридия и осмия.
Название элемента №76 происходит от греческого слова οσμη, что означает «запах». Неприятный раздражающий запах, похожий одновременно на запахи хлора и чеснока, появлялся, когда растворяли продукт сплавления осмиридия со щелочью. Носителем этого запаха оказался осмиевый ангидрид, или четырехокись осмия OsO 4 . Позже выяснилось, что так же скверно, хотя и значительно слабее, может пахнуть и сам осмий. Тонкоизмельченный, он постепенно окисляется на воздухе, превращаясь в OsO 4 ...
Осмий металлический
Осмий – оловянно-белый металл с серовато-голубым оттенком. Это самый тяжелый из всех металлов (его плотность 22,6 г/см 3) и один из самых твердых. Тем не менее осмиевую губку можно растереть в порошок, поскольку он хрупок. Плавится осмий при температуре около 3000°C, а температура его кипения до сих пор точно не определена. Полагают, что она лежит где-то около 5500°C.
Большая твердость осмия (7,0 по шкале Мооса), пожалуй, то из его физических свойств, которое используют наиболее широко. Осмий вводят в состав твердых сплавов, обладающих наивысшей износостойкостью. У дорогих авторучек напайку на кончик пера делают из сплавов осмия с другими платиновыми металлами или с вольфрамом и кобальтом. Из подобных же сплавов делают небольшие детали точных измерительных приборов, подверженные износу. Небольшие – потому что осмий мало распространен (5·10 –6 % веса земной коры), рассеян и дорог. Этим же объясняется ограниченное применение осмия в промышленности. Он идет лишь туда, где при малых затратах металла можно получить большой эффект. Например, в химическую промышленность, которая пытается использовать осмий как катализатор. В реакциях гидрогенизации органических веществ осмиевые катализаторы даже эффективнее платиновых.
Несколько слов о положении осмия среди прочих платиновых металлов. Внешне он мало от них отличается, но именно у осмия самые высокие температуры плавления и кипения среди всех металлов этой группы, именно он наиболее тяжел. Его же можно считать наименее «благородным» из платиноидов, поскольку кислородом воздуха он окисляется уже при комнатной температуре (в мелкораздробленном состоянии). А еще осмий – самый дорогой из всех платиновых металлов. Если в 1966 г. платина ценилась на мировом рынке в 4,3 раза дороже, чем золото, а иридий – в 5,3, то аналогичный коэффициент для осмия был равен 7,5.
Как и прочие платиновые металлы, осмий проявляет несколько валентностей: 0, 2+, 3+, 4+, 6+ и 8 +. Чаще всего можно встретить соединения четырех- и шестивалентного осмия. Но при взаимодействии с кислородом он проявляет валентность 8+.
Как и прочие платиновые металлы, осмий – хороший комплексообразователь, и химия соединений осмия не менее разнообразна, чем, скажем, химия палладия или рутения.
Ангидрид и другие
Несомненно, самым важным соединением осмия остается его четырехокись OsO 4 , пли осмиевый ангидрид. Как и элементарный осмий, OsO 4 обладает каталитическими свойствами; OsO 4 применяют при синтезе важнейшего современного лекарственного препарата – кортизона. При микроскопических исследованиях животных и растительных тканей четырехокись осмия используют как окрашивающий препарат. OsO 4 очень ядовит, он сильно раздражает кожу, слизистые оболочки и особенно вреден для глаз. Любая работа с этим полезным веществом требует чрезвычайной осторожности.
Внешне чистая четырехокись осмия выглядит достаточно обычно – бледно-желтые кристаллы, растворимые в воде и четыреххлористом углероде. При температуре около 40°C (есть две модификации OsO 4 с близкими точками плавления) они плавятся, а при 130°C четырехокись осмия закипает.
Другой окисел осмия – OsO 2 – нерастворимый в воде черный порошок – практического значения не имеет. Также не нашли пока практического применения и другие известные соединения элемента №76 – его хлориды и фториды, иодиды и оксихлориды, сульфид OsS 2 и теллурид OsTe 2 – черные вещества со структурой пирита, а также многочисленные комплексы и большинство сплавов осмия. Исключение составляют лишь некоторые сплавы элемента №76 с другими платиновыми металлами, вольфрамом и кобальтом. Главный их потребитель – приборостроение.
Как получают осмий
Самородный осмий в природе не найден. Он всегда связан в минералах с другим металлом платиновой группы – иридием. Существует целая группа минералов осмистого иридия. Самый распространенный из них – невьянскит, природный сплав этих двух металлов. Иридия в нем больше, поэтому невьянскит часто называют просто осмистым иридием. Зато другой минерал – сысертскит – называют иридистым осмием – в нем больше осмия... Оба эти минерала – тяжелые, с металлическим блеском, и это не удивительно – таков их состав. И само собой разумеется, все минералы группы осмистого иридия очень редки.
Иногда эти минералы встречаются самостоятельно, чаще же осмистый иридий входит в состав самородной сырой платины. Основные запасы этих минералов сосредоточены в СССР (Сибирь, Урал), США (Аляска, Калифорния), Колумбии, Канаде, странах Южной Африки.
Естественно, что добывают осмий совместно с платиной, но аффинаж осмия существенно отличается от способов выделения других платиновых металлов. Все их, кроме рутения, осаждают из растворов, осмий же получают отгонкой его относительно летучей четырехокиси.
Но прежде чем отгонять OsO 4 , нужно отделить от платины осмистый иридий, а затем разделить иридий и осмий.
Когда платину растворяют в царской водке, минералы группы осмистого иридия остаются в осадке: даже этот из всех растворителей растворитель не может одолеть эти устойчивейшие природные сплавы. Чтобы перевести их в раствор, осадок сплавляют с восьмикратным количеством цинка – этот сплав сравнительно просто превратить в порошок. Порошок спекают с перекисью бария BaO 3 , а затем полученную массу обрабатывают смесью азотной и соляной кислот непосредственно в перегонном аппарате – для отгонки OsO 4 .
Ее улавливают щелочным раствором и получают соль состава Na 2 OsO 4 . Раствор этой соли обрабатывают гипосульфитом, после чего осмий осаждают хлористым аммонием в виде соли Фреми Cl 2 . Осадок промывают, фильтруют, а затем прокаливают в восстановительном пламени. Так получают пока еще недостаточно чистый губчатый осмий.
Затем его очищают, обрабатывая кислотами (HF и HCl), и довосстанавливают в электропечи в струе водорода. После охлаждения получают металл чистотой до 99,9% O 3 .
Такова классическая схема получения осмия – металла, который применяют пока крайне ограниченно, металла очень дорогого, но достаточно полезного.
Чем больше, тем... больше
Природный осмий состоит из семи стабильных изотопов с массовыми числами 184, 186...190 и 192. Любопытная закономерность: чем больше массовое число изотопа осмия, тем больше он распространен. Доля самого легкого изотопа, осмия-184, – 0,018%, а самого тяжелого, осмия-192, – 41%. Из искусственных радиоактивных изотопов элемента №76 самый долгоживущий – осмий-194 с периодом полураспада около 700 дней.
Карбонилы осмия
В последние годы химиков и металлургов все больше интересуют карбонилы – соединения металлов с СО, в которых металлы формально нульвалентны. Карбонил никеля уже довольно широко применяется в металлургии, и это позволяет надеяться, что и другие подобные соединения со временем смогут облегчить получение тех или иных ценных материалов. Для осмия сейчас известны два карбонила. Пентакарбонил Os(CO) 5 – в обычных условиях бесцветная жидкость (температура плавления – 15°C). Получают его при 300°C и 300 атм. из четырехокиси осмия и угарного газа. При обычных температуре и давлении Os(CO) 5 постепенно переходит в другой карбонил состава Os 3 (CO) 12 – желтое кристаллическое вещество, плавящееся при 224°C. Интересно строение этого вещества: три атома осмия образуют равносторонний треугольник с гранями длиной 2,88 Å, а к каждой вершине этого треугольника присоединены по четыре молекулы СО.
Фториды спорные и бесспорные
«Фториды OsF 4 , OsF 6 , OsF 8 образуются из элементов при 250...300°C... OsF 8 – самый летучий из всех фторидов осмия, т. кип. 47,5°»... Эта цитата взята из III тома «Краткой химической энциклопедии», выпущенного в 1964 г. Но в III томе «Основ общей химии» Б.В. Некрасова, вышедшем в 1970 г., существование октафторида осмия OsF 8 отвергается. Цитируем: «В 1913 г. были впервые получены два летучих фторида осмия, описанные как OsF 6 и OsF 8 . Так и считалось до 1958 г., когда выяснилось, что в действительности они отвечают формулам OsF 5 и OsF 6 . Таким образом, 45 лет фигурировавший в научной литературе OsF 8 на самом деле никогда не существовал. Подобные случаи «закрытия» ранее описанных соединений встречаются не так уж редко».
Заметим, что и элементы тоже иногда приходится «закрывать»... Остается добавить, что, помимо упомянутых в «Краткой химической энциклопедии», был получен еще один фторид осмия – нестойкий OsF 7 . Это бледно-желтое вещество при температуре выше –100°C распадается на OsF 6 и элементарный фтор.
Статья от декабря 2014 года, в которой детально описан мировой рынок зерна.
Рынок зерна – весьма динамичный, а колебания в экспорте – невероятно велики.
Настолько, что даже различные официальные источники, в том числе – статистические, предоставляют существенно различающуюся информацию.
Многие страны сами ставят себя на высокие позиции в экспорте.
Пришлось не только искать «логичное среднее» значение, но и составлять после этого баланс мирового экспорта зерна, чтобы не получилось (как в некоторых странах), что намолот зерна намного ниже декларируемого этой страной экспорта.
Причем, этим грешат не только середнячки и отстающие, но и страны-лидеры мирового экспорта зерна, в частности - United States Department of Agriculture.
Под зерном понимается и пшеница, и другие виды злаковых культур. Отделить экспорт пшеницы в отчетности в ряде случаев просто невозможно.
Данные, в основном, по 2012-2013 годам. При анализе и расчете учитывались также прогноз и фактический намолот зерна по состоянию на конец октября 2014 года (разумеется, в тех странах, которые это публикуют).
Больше всех зерна производят Китай и Индия – 115 и 80 млн тонн, но у них и население больше, настолько, что по удельному производству зерна на душу населения они далеко позади.
Несколько слов о лжи в этой проблеме.
США, если верить российской WiKi, производят 60 млн тонн, Канада – 23 млн тонн.
Но США и Канада экспортируют больше, соответственно - 72.3 и 28 млн тонн зерна в год – это данные международных Агентств.
Получается - народ не видит хлеба, а животные - сухого корма - зерна?
Европейский Союз экспортирует 38.5 млн тонн.
Украина – 32.3 млн тонн, и только в прошлом году она вышла на 3-е место.
По прогнозу Министерства экономики и развития страны, в 2014-15 годах Украина экспортирует 32 миллиона тонн зерновых.
Хотя Украина (по всем меркам) – зерновая страна, она всегда плелась «в хвосте» экспортеров, и лишь в последнее десятилетие экспорт зерна из Украины вырос на 77%.
Канада, как уже было сказано выше – 28 млн тонн.
Австралия – 23.3 млн тонн.
Аргентина – 21.9 млн тонн.
Бразилия 20 млн тонн.
Россия – 19 млн тонн, причем основные потребители российского экспорта зерна – страны Северной Африки и Ближнего Востока.
Однако прогноз экспорта по 2014 году – 30 млн тонн, что, если так оно и будет, выведет Россию на 4-е место в мире.
Любопытен Казахстан – когда-то Север этой страны был превращен в одно большое зерновое поле. Однако только что поступило сообщение - Северо-Казахстанская область (та самая, что некогда была цветущей целиной) увеличила импорт пшеницы из России.
Хорошее сообщение для производителей: весь октябрь на мировых биржах в отношении пшеницы преобладал растущий тренд.
Продовольственная и сельскохозяйственная организация ООН (ФАО) увеличила прогноз по мировому производству зерновых в 2016 году. Так, оно должно составить 2 571 млн тонн, что на 1,5% больше, чем в 2015 году.
Об этом сообщает пресс-служба ФАО.
В частности, ФАО существенно увеличило прогноз по мировому производству пшеницы, которое, как ожидается, вырастет до 746,7 млн тонн, что на 4,3 млн больше по сравнению с октябрьским прогнозом ФАО.
По прогнозам ФАО, производство пшеницы в Российской Федерации установит новый рекорд. Кроме того, благоприятные погодные условия привели к увеличению прогноза на урожай в Казахстане.
"Увеличение мирового производства пшеницы и ячменя более чем компенсирует ожидаемое снижение мирового урожая кукурузы на 4,8 млн тонн в 2016 из-за неблагоприятных погодных условий в Бразилии, Китае, Европейском союзе и Соединенных Штатах Америки. Прогноз по мировому производству риса остался практически неизменным", - говорят в организации.
Отмечается, что ранние прогнозы по урожаю озимой пшеницы 2017 года в северном полушарии указывают на то, что фермеры США уменьшают посевные площади вследствие прогнозов по снижению цен и экспорта в результате укрепления доллара. Тем не менее, посевы пшеницы в Российской Федерации и Украине опережают темпы прошлого года.
В странах северного полушария идет сев озимой пшеницы урожая 2017 года. В США под влиянием ожидаемых низких цен и снижения экспортных возможностей в связи с укреплением доллара США вероятно сокращение посевных площадей. В Российской Федерации и на Украине посевная кампания идет опережающими темпами по сравнению с прошлым годом.
В странах южного полушария в настоящее время идет посев яровых культур урожая 2017 года; благоприятные, в целом, погодные условия в Южной Америке способствуют раннему развитию растений. В Аргентине ожидается расширение площадей под кукурузу на 6,0% по сравнению с прошлым годом.
Также сообщается, что общее потребление зерновых в 2016/2017 маркетинговом сезоне теперь прогнозируется на уровне 2 562 млн тонн, что немного выше по сравнению с октябрьским прогнозом и на 1,7% выше показателя годом ранее.
Основным фактором роста спроса на зерновые является увеличение мирового спроса на корма, который, по прогнозам, вырастет на 2,7%. Использование пшеницы в качестве кормов для животных, подстегиваемое обильным предложением низкокачественной пшеницы, как ожидается, вырастет на 6,1% до 146,6 млн тонн и установит новый мировой рекорд.
Глобальное потребление зерновых прогнозируется на уровне 1 106 млн тонн, что на 1,3% больше по сравнению с аналогичным показателем год назад.
"Этого объема будет достаточно, чтобы поддерживать в целом стабильный уровень потребления на душу населения в мире", - говорят в ФАО.
Кроме того, Продовольственная и сельскохозяйственная организация ООН прогнозирует, что мировые запасы зерновых увеличатся до 662 млн тонн к концу сезонов 2017 года, что обусловлено ростом запасов пшеницы, особенно в Китае, США и России. Запасы кормового зерна, по прогнозам, сократятся на 1,7%, в результате снижения уровня запасов в Китае, Бразилии и Южной Африке. Мировые запасы риса, как ожидается, снизятся незначительно до 169,8 млн тонн.
- Граница между европой и азией Америка относится к европе
- Как экономить деньги при маленькой зарплате?
- Порядок получения жилищной субсидии для военнослужащих
- Лимит кассы: нормативная база и сроки установления лимита
- Полная система вычетов Алгебраическая форма комплексного числа
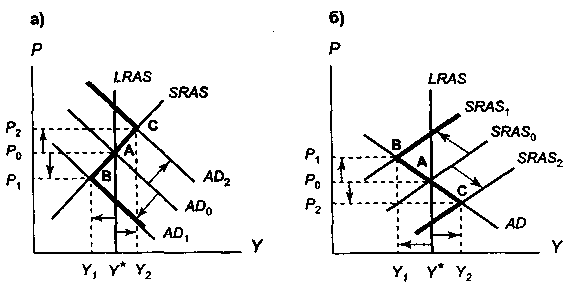
- Модель «Совокупный спрос – совокупное предложение Увеличение совокупного спроса вызывает
- Что называется периодом в физике
- Виды и типы недвижимости, их экономическая составляющая Поля инициализаторов типа
- Экономика, население и города Чеченской Республики
- Особенности проведения региональной программы материнский капитал в московской области Региональный материнский капитал программе семья
- Должностная инструкция страхового агента росгосстрах
- Учет материалов на складе и в бухгалтерии
- На вопрос «Можно ли строить дом без разрешения на строительство?
- Ип на осно какие налоги платит?
- Доходы и расходы будущих периодов Как распределить расходы, затрагивающие несколько налоговых периодов
- Экономические циклы, их особенности и виды
- Необходимо знать от чего зависят цены на жилье
- Контрольная работа: Экономическая мысль Древней Греции
- Бухгалтерские проводки по реализации товаров и услуг 1с бухгалтерия 8
- Оборотные активы организации