Провозглашенный горбачевым курс на ускорение. Перестройка в ссср
(Пока оценок нет)
Что такое марганцовка? Это бытовое название калиевой соли марганцевой кислоты, которая ещё имеет название перманганат калия или марганцовокислый калий. Твёрдое вещество в форме мельчайших кристаллов тёмно-фиолетового цвета со стеклянным блеском знакомо практически всем. В состав вещества входит марганец, калий и кислород. Хорошо растворяется в воде, является отличным окислителем. Обладает широким спектром специфических свойств, которые ценятся и используются в медицине (традиционной и народной), косметологии, ветеринарии и в быту.
 Перманганат калия в водном растворе разлагается, в результате чего выделяется осадок темного коричневого цвета – диоксид марганца. При взаимодействии слабо концентрированного осадка с органическими белками образуются особые вещества, создающие на раневой поверхности тонкую плёнку – так проявляет себя вяжущее воздействие марганцовки.
Перманганат калия в водном растворе разлагается, в результате чего выделяется осадок темного коричневого цвета – диоксид марганца. При взаимодействии слабо концентрированного осадка с органическими белками образуются особые вещества, создающие на раневой поверхности тонкую плёнку – так проявляет себя вяжущее воздействие марганцовки.
В высокой концентрации, наоборот, проявляется раздражающее и прижигающее действие марганца на организм человека.
Кроме того, при контакте с легко окисляемой органической поверхностью, водный раствор марганцовки начинает активно выделять атомарный кислород, известный своей способностью убивать микробы и бактерии. Поэтому перманганат калия с давних времён славится своим антисептическим действием.
Выделяющийся атомарный кислород обладает ещё и дезодорирующим свойством — он окисляет летучие соединения пахучих веществ, убирая неприятные запахи.
Опасна марганцовка тем, что чрезмерная концентрация или употребление кристаллов внутрь может вызвать сильнейшие ожоги и отравление.
Применение в медицине
Марганцовка нашла применение в медицине. Растворы марганцовки в различных разведениях используются медиками в комплексном лечении многих заболеваний:
- Токсикологи с их помощью нейтрализуют интоксикацию, вызванную алкалоидами (стрихнином, кофеином, никотином, кокаином). При пищевых отравлениях промывание желудка слабым раствором марганцовки является самым лучшим средством первой помощи.
- Хирурги используют свежеприготовленные растворы марганцовки для обработки ран и нарывов при анаэробных и гнилостных инфекциях. Очень эффективны они и при гнойной инфекции мягких тканей пальцев – панариции.
- Гинекологи и урологи применяют средство для лечения грибковых, бактериальных и воспалительных заболеваний. Хорошее действие окажут ежедневные процедуры спринцевания при молочнице у женщин, и промывания при наружных воспалительных процессах у мужчин.
- Стоматологи проводят орошение воспалённых мест при стоматите, гингивите и пародонтозе. В слабой концентрации средство подходит для ополаскивания рта во время лечения зубов, что позволяет избежать инфицирования.
- Дерматологи таким образом лечат различные кожные заболевания. Смазывание высыпаний при ветряной оспе, например, снимает зуд и боль, способствует быстрейшему рубцеванию. При ожоге образующаяся плёнка предохраняет повреждённую поверхность от раздражений и уменьшает болевые ощущения.
Использование при уходе за детьми
 Вопрос о том, добавлять или не добавлять марганцовку при купании новорождённых — неоднозначен. Врачи, учитывая обеззараживающие действие вещества, рекомендуют такие ванночки, пока свежа пупочная ранка. Длительное купание в такой воде может привести к сухости и шелушению кожи, а также вызвать аллергическую реакцию.
Вопрос о том, добавлять или не добавлять марганцовку при купании новорождённых — неоднозначен. Врачи, учитывая обеззараживающие действие вещества, рекомендуют такие ванночки, пока свежа пупочная ранка. Длительное купание в такой воде может привести к сухости и шелушению кожи, а также вызвать аллергическую реакцию.
Готовить раствор нужно очень внимательно и аккуратно. Запрещено сыпать кристаллы перманганата сразу в ванночку. Некоторые из них могут не раствориться и вызвать ожог кожи и глаз. Также существует опасность ошибиться с концентрацией.
Готовить воду для купания нужно последовательно:
- растворить марганцовку в стакане;
- процедить через плотный марлевый фильтр;
- вливать в ванночку, до получения светло-розового цвета.
Только выполнив такие требования, вы будете уверены в полной безопасности вашего малыша.
Применение в народной медицине
Баночка с кристаллами марганцовки найдётся, наверное, в каждом доме. В народе давно знают и ценят это средство за его доступность, эффективность и широкую сферу применения. Существует множество народных, так называемых «бабушкиных» рецептов, передающихся из поколения в поколение, основанных на применении марганцевого раствора:

В случае появления побочных эффектов в виде отёка, необычной окраски слизистых, острой боли или судорог – лечение марганцовкой нужно немедленно прекратить.
Использование в быту
Широкое применение марганцовки в быту объясняется её многочисленными замечательными свойствами. С её помощью:

Нужно знать, что калия перманганат может быть взрывоопасен при взаимодействии с некоторыми веществами (углем, танином, сахаром). Поэтому его кристаллы должны храниться в стеклянных, плотно закрытых ёмкостях, в недоступной для детей зоне. Производители указывают срок годности марганцовки – не более 5 лет в прохладном (не выше 25 0 С) месте.
Практика показывает, что сохранять свои свойства в сухом виде марганцовка может гораздо дольше, тогда как срок годности готового раствора не превышает и двух дней.
Марганцовка – уникальное средство, сфера применения и популярность которого с годами только растёт. Она принесёт ещё немало пользы людям, при условии грамотного хранения и использования.
Марганец — элемент таблицы Менделеева, черный металл, так же как и железо. В чистом виде не встречается, в основном существует в виде оксидов в марганцевых и железных рудах. Марганец — рассеянный элемент: в очень небольших количествах содержится в почвах, в растениях, в организмах животных. В воде почти не содержится, реками выносится с суши в Мировой океан, где накапливается в глубоких местах.
Свойства
Немагнитный металл светло-серебристого цвета, быстро покрывается оксидной пленкой, хрупкий, твердый. Активно вступает в реакции (при нагревании) с неметаллами, соляной и разбавленной серной кислотой, проявляет валентность от 2 до 7. Плохо реагирует с водой. Образует кислоты и щелочи, соответствующие им соли, сплавы со многими металлами.
Марганец играет важную роль в жизнедеятельности человека: участвует в работе нервной, иммунной, половой систем; в белковом, углеводном и жировом обмене; в процессах кроветворения, пищеварения, роста; необходим для правильного формирования плода. При длительном (около 3 лет) вдыхании пыли на промышленном производстве возможно отравление марганцем.
В различных сферах производства реактив применяется и в чистом виде, и в виде соединений.
Применение марганца
 — Почти 90% всего металла расходуется в черной металлургии. В виде ферромарганца — сплава с железом, его добавляют в сталь, чтобы повысить ее ковкость, прочность, износоустойчивость. Хим. реактив необходим для процессов легирования, десульфурации, «раскисления» сталей.
— Почти 90% всего металла расходуется в черной металлургии. В виде ферромарганца — сплава с железом, его добавляют в сталь, чтобы повысить ее ковкость, прочность, износоустойчивость. Хим. реактив необходим для процессов легирования, десульфурации, «раскисления» сталей.
— Добавляется в сталь Гадфильда (до 13%), обладающую выдающейся твердостью. Из нее делают землеройные и камнедробильные машины, элементы брони.
— В цветной металлургии входит в состав железо несодержащих сплавов, в бронзу, латунь, большинство алюминиевых и магниевых сплавов для улучшения их прочности и устойчивости к коррозии.
— Используется при изготовлении сплава из марганца, меди и никеля, отличающегося высоким сопротивлением. Этот сплав востребован в электротехнике.
— Применяется для создания устойчивых к коррозии гальванических покрытий металлических изделий.
Применение соединений марганца
— В органическом синтезе в качестве окислителей и катализаторов;  в полиграфии и производстве красок; в стекольной и керамической индустрии.
в полиграфии и производстве красок; в стекольной и керамической индустрии.
— В сельском хозяйстве в качестве микроудобрений, для обработки семян.
— Двуокись марганца применяется в различных областях: при изготовлении гальванических элементов; цветных глазурей и эмалей для керамики; в химической индустрии, в органическом и неорганическом синтезе; мелкодисперсионный порошок применяют для поглощения вредных примесей из воздуха.
— Теллурид марганца используют в термоэлектрике.
— Арсенид марганца обладает выраженным магнитокалористическим эффектом, на основе которого основан перспективный метод для создания компактных и экономных холодильных установок нового типа.
— Перманганат калия — популярный антисептик в медицине, антидот при отравлении цианидами и алкалоидами; отбеливающее средство в текстильной промышленности; окислитель в органическом синтезе.
В Prime Chemicals Group вы можете купить различные соединения марганца, а также другие химреактивы , посуду и оборудование, необходимые для лабораторий и производств. Менеджеры помогут разобраться в широком ассортименте, выбрать нужные товары и оформить покупку. Хорошие цены и сервис делают сотрудничество с нами комфортным.
Марганец является химическим элементом, расположившимся в периодической системе Менделеева под атомным номером 25. Его соседями являются хром и железо, что обуславливает сходство физических и химических свойств этих трех металлов. Его ядро содержит 25 протонов и 30 нейтронов. Атомная масса элемента составляет 54,938.
Свойства марганца
Марганец является переходным металлом из d-семейства. Его электронная формула выглядит следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 . Твердость марганца по шкале Мооса оценивается на 4. Металл является достаточно твердым, но, в то же время, хрупким. Его теплопроводность составляет 0,0782 Вт/см*К.. Элемент характеризуется серебристо-белым окрасом.
Существует четыре, известные человеку, модификации металла. Каждой из них присуща термодинамическая устойчивость при определенных температурных условиях. Так, а-марганец обладает достаточно сложной структурой и проявляет свою устойчивость при температуре, ниже 707 0 С, чем и обуславливается его хрупкость. Данная модификация металла в элементарной своей ячейке содержит 58 атомов.

Марганец может иметь совершенно разную степень окисления - от 0 до +7, при этом +1 и +5 встречаются крайне редко. При взаимодействии металла с воздухом, он пассивируется. В кислороде происходит сгорание порошкообразного марганца:
Mn+O2=MnO2
Если воздействовать на металл повышенной температурой, т.е. нагреть, то произойдет его разложение на воду с вытеснением водорода:
Mn+2H0O=Mn(OH)2+H2
Стоит отметить, что гидроксид марганца, слой которого образуется в результате реакции, замедляет процесс реакции.
Водород поглощается металлом. Чем выше повышается температура, тем выше становится его растворимость в марганце. Если превысить температуру в 12000С, то марганец вступает в реакцию с азотом, в результате которой образуются нитриты, имеющие разный состав.
Металл также взаимодействует с углеродом. Результатом данной реакции является образование карбидов, а также силицидов, боридов, фосфидов.
Металл обладает устойчивостью к воздействию на него щелочными растворами.
Он способен образовывать следующие оксиды: MnO, Mn 2 O 3 , MnO 2 , MnO 3 , последний из которых в свободном состоянии не выделен, а также марганцевый ангидрид Mn 2 O 7 . При обычных условиях существования марганцевый ангидрид представляет собой жидкое маслянистое вещество темно-зеленого цвета, не имеющего особой устойчивости. Если температуру повысить до 90 0 С, то разложение ангидрида сопровождается взрывом. Среди оксидов, которые проявляют наибольшую устойчивость, выделяют Mn 2 O 3 и MnO 2 , а также комбинированный оксид Mn 3 O 4 (2MnO·MnO 2 , или соль Mn 2 MnO 4).
Оксиды марганца:
Во время сплавления пиролюзита и щелочей с присутствием кислорода, происходит реакция с образованием манганатов:
2MnO 2 +2KOH+O 2 =2K 2 MnO 4 +2H 2 O
Для раствора манганата характерен темно-зеленый окрас. Если его подкислить, то протекает реакция с подкрашиванием раствора в малиновый цвет. Это происходит по причине образования аниона MnO 4 − , из которого выпадает осадок оксида-гидроксида марганца, имеющего коричневый окрас.
Марганцевая кислота является сильной, однако не проявляет особой устойчивости, в связи с чем, допустимая максимальная ее концентрация составляет не более 20%. Сама же кислота, как и ее соли, выступает сильным окислителем.
Соли марганца не проявляют устойчивости. Для его гидроксидов характерный основный характер. Хлорид марганца разлагается при воздействии него высокими температурами. Именно данную схему применяют для получения хлора.

Применение марганца
Данный металл не является дефицитным - он относится к распространенным элементам: его содержание в земной коре составляет 0,03% от общего количества атомов. Ему принадлежит третье место в рейтинге среди тяжелых металлов, к которым относятся все элементы переходных рядов, пропустив вперед железо и титан. Тяжелыми металлами считаются те, атомный вес которых превышает 40.
Марганец в незначительных количествах можно обнаружить в некоторых горных породах. В основном, встречается локализация его кислородных соединений в виде минерала пиролюзита - MnO 2 .
Марганец имеет множество направлений своего применения. Он необходим для производства многих сплавов и химических веществ. Без марганца невозможно существование живых организмов, так он выступает в качестве активного микроэлемента, а также присутствует практически во всех живых и растительных организмах. Марганец позитивно влияет на процессы кроветворения в живых организмах. Также он содержится во многих пищевых продуктах.

Металл является незаменимым элементом в металлургии. Именно марганец применяется для удаления серы и кислорода из стали во время ее производства. Для данного процесса необходимы большие объемы металла. Но стоит сказать, что в расплав добавляется не чистый марганец, а его сплав с железом, именуемый ферромарганцем. Он получается в процессе восстановительной реакции пиролюзита углем. Также марганец выступает легирующим элементом для сталей. Благодаря добавке марганца к сталям, существенно увеличивается их износостойкость, а также они становятся менее подверженными механическим напряжениям. Присутствие марганца в составе цветных металлов существенно повышает их прочность и устойчивость к коррозии.
Диоксид металла нашел свое применение при окислении аммиака, а также он является участником органических реакций и реакций разложения неорганических солей. В данном случае диоксид марганца выступает катализатором.
Керамическая промышленность также не обходится без использования марганца, где MnO 2 применяется в качестве черного и темно-коричневого красителя для эмалей и глазурей. Оксид марганца является высокодисперсным. Ему присуща хорошая адсорбирующая способность, благодаря которой становится возможным удалять из воздуха вредные примеси.
Марганец вводится в бронзу и латунь. Некоторые соединения металла применяются в тонком органическом синтезе и в промышленном органическом синтезе. Арсениду марганца свойственен гигантский магнитокалорический эффект, который становится существенно сильнее, если воздействовать на него высоким давленим. Теллурид марганца выступает в качестве перспективного термоэлектрического материала.
В медицине также уместно использование марганца, а точнее его солей. Так, водный раствор перманганата калия используется в качестве антисептического средства, а также им можно промывать раны, полоскать горло, смазывать язвы и ожоги. При некоторых отравлениях алкалоидами и цианидами его раствор даже показан для приема во внутрь.

Важно: Не смотря на огромное количество положительных сторон использования марганца, в некоторых случаях его соединения могут пагубно влиять на организм человека и даже оказывать токсичное действие. Так, максимально допустимым значением концентрации марганца в воздухе является 0,3 мг/м 3 . В случае ярко выраженного отравления веществом поражается нервная система человека, для чего характерным является синдром марганцевого паркинсонизма.
Получение марганца
Металл можно получить несколькими способами. Среди наиболее популярных методов выделяют следующие:
- алюминотермический. Марганец получается из его оксида Mn 2 O 3 путем восстановительной реакции. Оксид, в свою очередь, образуется во время прокаливания пиролюзита:
4MnO 2 = 2Mn 2 O 3 +O 2
Mn 2 O 3 +2Al = 2Mn+Al 2 O 3
- восстановительный. Марганец получают путем восстановления металла коксом из марганцевых руд, в результате чего образуется ферромарганец (сплав марганца и железа). Данный метод является наиболее распространенным, так как основная масса от общей добычи металла используется во время производства разнообразных сплавов, основным компонентом которых является железо, в связи с этим из руд марганец извлекают не в чистом виде, а в сплаве с ним;
- электролиза. Металл в чистом виде получают с помощью данного способа из его солей.
Министерство образования и науки Украины
Национальный горный университет
Кафедра экологии
Поисково-аналитическая работа
По дисциплине: «Экология человека»
На тему: «Марганец»
Выполнила:
Ст. группы ГЕк-02-1
Филоненко Е. С.
Проверил:
Богданов В. К.
Днепропетровск
Введение
1. Историческая справка........................................................................4
2. Применение марганца........................................................................5
3. Получение марганца...........................................................................5
4. Соединения марганца в биологических системах...........................5
5. Объем производства марганцевой руды по предприятиям.............6
6. Марганцевые удобрения.....................................................................6
7. Заболевание вызываемые токсином Марганца.............................7
Список литературы
Введение
Во второй половине ХХ века основную опасность для здоровья населения и проблему для здравоохранения стали представлять неинфекционные заболевания, в первую очередь болезни ЦНС, и сердечно-сосудистой системы.
В данной поисково-аналитической роботе речь пойдет о химическом элементе Марганец .
Эту тему я взяла, так как сегодня она актуальна. Каждый третий человек болен какой-то болезнью, связанной с некоторыми элементами периодической системы Менделеева.
Марганец
Историческая справка
Минералы Марганца известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите MnO 2 . В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка. В 1774 году К.Шелле доказал, что это соединение неизвестного металла, а другой шведский учёный Ю.Гаи, сильно нагревая смесь пиролюзита с углём, получил Марганец загрязнённый углеродом. Название Марганец традиционно происходит от немецкого Marganerz -марганцевая руда.
Марганец - серебристо-белый твёрдый хрупкий металл. Известны четыре кристаллические модификации марганца, каждая из которых термодинамически устойчива в определённом интервале температур. Ниже 707 0 С устойчив a-марганец, имеющий сложную структуру - в его элементарную ячейку входят 58 атомов. Сложность структуры марганца при температурах ниже 707 0 С обусловливает его хрупкость.
Некоторые физические константы марганца приведены ниже:
Плотность, г/см 3 ....................................................... 7,44
Т. Пл., 0 С................................................................. 1245
Т.кип., 0 С................................................................ ~2080
S 0 298 , Дж / град · моль........................................................... 32,0
DH возг. 298, кДж / моль...................................................... 280
E 0 298 Mn 2+ + 2e = Mn, В........................................... -1,78
Марганец - d-элемент VII группы периодической системы, с конфигурацией валентных электронов 3d 5 4s 2 .
Некоторые сведения об этом элементе приведены ниже:
Атомная масса.................................................... 54,9380
Валентные электроны........................................... 3d 5 4s 2
Металлический атомный радиус, нм..................... 0,130
Условный радиус иона Mn 2+ , нм........................... 0,052
Условный радиус иона Mn 7+ , нм........................... 0,046
Энергия ионизации Mn 0 ® Mn + , эВ........................ 7,44
Применение марганца
Марганец принадлежит к весьма распространённым элементам, составляя 0,03% от общего числа атомов земной коры. Среди тяжёлых металлов (атомный вес больше 40), к которым относятся все элементы переходных рядов, марганец занимает по распространенности в земной коре третье место вслед за железом и титаном. Небольшие количества марганца содержат многие горные породы. Вместе с тем, встречаются и скопления его кислородных соединений, главным образом в виде минерала пиролюзита - MnO 2 .
Марганец в большом количестве применяется в металлургии в процессе получения сталей для удаления из них серы и кислорода. Однако в расплав добавляют не марганец, а сплав железа с марганцем - ферромарганец, который получают восстановлением пиролюзита углём. Добавки марганца к сталям повышают их устойчивость к износу и механическим напряжениям. В сплавах цветных металлов марганец увеличивает их прочность и устойчивость к коррозии.
Диоксид марганца используют в качестве катализатора в процессах окисления аммиака, органических реакциях и реакциях разложения неорганических солей. В керамической промышленности MnO 2 используют для окрашивания эмалей и глазурей в черный и тёмно-коричневый цвет. Высокодисперсный MnO 2 обладает хорошей адсорбирующей способностью и применяется для очистки воздуха от вредных примесей.
Перманганат калия применяют для отбеливания льна и шерсти, обесцвечивания технологических растворов, как окислитель органических веществ.
В медицине применяют некоторые соли марганца. Например, перманганат калия применяют как антисептическое средство в виде водного раствора, для промывания ран, полоскания горла, смазывания язв и ожогов. Раствор KMnO 4 применяют и внутрь при некоторых случаях отравления алкалоидами и цианидами. Марганец является одним из активнейших микроэлементов и встречается почти во всех растительных и живых организмах. Он улучшает процессы кроветворения в организмах.
Не стоит забывать, что соединения марганца могут оказывать токсичное действие на организм человека. Предельно допустимая концентрация марганца в воздухе 0.3 мг/м 3 . При выраженном отравлении наблюдается поражение нервной системы с характерным синдромом марганцевого паркинсонизма .
Получение марганца
Чистый марганец может быть получен электролизом растворов его солей. Однако, поскольку 90% всей добычи марганца потребляется при изготовлении различных сплавов на основе железа, из руд обычно выплавляют прямо его высокопроцентный сплав с железом – ферромарганец.
Соединения марганца в биологических системах
Марганец весьма интересен в биохимическом отношении. Точные анализы показывают, что он имеется в организмах всех растений и животных. Содержание его обычно не превышает тысячных долей процента, но иногда бывает значительно выше.
Марганец принадлежит к числу немногих элементов, способных существовать в восьми различных состояниях окисления. Однако в биологических системах реализуются только два из этих состояний: Mn (II) и Mn (III).
Объем производства марганцевой руды по предприятиям
| - Марганецкий ГОК - Орджоникидзевский ГОК |
Марганецкий ГОК
Месторождение марганцевых руд было открыто в 1883 году. В 1985 г. на базе этого месторождения начал добычу руды Покровский рудник. По мере развития рудника и возникновения новых карьеров и шахт сформировался Марганецкий ГОК.
В составе производственной структуры комбината: два карьера для открытой добычи марганцевой руды, пять шахт для подземной добычи, три обогатительных фабрики, а также необходимые вспомогательные цеха и службы, в т.ч. ремонтно-механический, транспортный и пр.
Орджоникидзевский ГОК
Основным видом выпускаемой продукции является марганцевый концентрат различных сортов с содержанием чистого марганца от 26% до 43% (в зависимости от сортности). Попутные продукты - керамзитовая глина и шламы.
Добычу марганцевой руды предприятие ведется на закрепленных за ним рудных полях. Запасов руд хватит на срок более 30 лет. Запасы марганцевой руды в Украине суммарно по Орджоникидзевскому и Марганцевому горно-обогатительным комбинатам составляет треть всех мировых запасов.
Марганцевые удобрения
Марганцевыми удобрениями служат марганцевые шлаки, содержащие до 15% марганца, а также сернокислый марганец. Но наибольшее распространение получил марганизированный суперфосфат, содержащий около 2-3% марганца.
Микроудобрения применяют также в виде некорневых подкормок, опрыскивая растения соответствующим раствором или замачивая в нем семена перед посевом.
Марганец активно влияет на обмен белков, углеводов и жиров. Важной также считается способность марганца усиливать действие инсулина и поддерживать определенный уровень холестерина в крови. В присутствии марганца организм полнее использует жиры. Сравнительно богаты этим микроэлементом крупы (в первую очередь овсяная и гречневая), фасоль, горох, говяжья печень и многие хлебобулочные изделия, которыми практически восполняется суточная потребность человека в марганце - 5,0-10,0 мг.
Заболевание вызываемые токсином Марганца
Как было сказано выше, соединения марганца вызывают токсичное воздействие на человека. Самое распостранненое заболевание – это синдром Паркинсона. Также следствие этих токсинов бывают заболевания: Центрально - Нервной Системы, пневмония, рак желудка и летаргия.
Болезнь Паркинсона
Болезнь Паркинсона - это наследственное заболевание в связи с поражением (дегенерацией нейронов) подкоркового образования мозга - «черной субстанции» из-за отсутствия фермента (L-тирозингидрогеназы) и снижения ДОФАмина. Страдая «дрожательным параличом» Джемс Паркинсон - врач, описал «свое заболевание» в литературе в 1818 году, а один из известнейших невропатологов - Шарко назвал его «болезнью Паркинсона». Частота заболевания до 70 лет - 180 больных на 100 000 населения. после 70 лет - 1800 больных на 100 000 населения. Мужчины болеют в 1.6 раза чаще, чем женщины.
Одним из самых важных для металлургии металлов является марганец. Кроме того, он вообще достаточно необычный элемент, с которым связаны интересные факты. Важный для живых организмов, нужный при получении многих сплавов, химических веществ. Марганец - фото которого можно увидеть ниже. Именно его свойства и характеристики рассмотрим в данной статье.
Характеристика химического элемента
Если говорить о марганце как об элементе то в первую очередь следует охарактеризовать его положение в ней.
- Располагается в четвертом большом периоде, седьмой группе, побочной подгруппе.
- Порядковый номер - 25. Марганец - химический элемент, атомов которого равен +25. Количество электронов такое же, нейтронов - 30.
- Значение атомной массы - 54,938.
- Обозначение химического элемента марганца - Mn.
- Латинское название - manganese.
Располагается между хромом и железом, чем объясняется его сходство с ними в физических и химических характеристиках.
Марганец - химический элемент: переходный металл
Если рассмотреть электронную конфигурацию приведенного атома, то ее формула будет иметь вид: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 . Становится очевидно, что рассматриваемый нами элемент - это из d-семейства. Пять электронов на 3d-подуровне говорят о стабильности атома, что и проявляется в его химических свойствах.
Как металл марганец является восстановителем, однако большая часть его соединений способна проявлять и достаточно сильные окислительные способности. Это связано с различными степенями окисления и валентностями, которыми обладает данный элемент. В этом заключается особенность всех металлов данного семейства.
Таким образом, марганец - химический элемент, располагающийся среди других атомов и имеющий свои особенные характеристики. Рассмотрим, какие это свойства, более подробно.

Марганец - химический элемент. Степень окисления
Мы уже привели электронную формулу атома. Согласно ей, данный элемент способен проявлять несколько положительных степеней окисления. Это:
Валентность атома равна IV. Самыми устойчивыми являются те соединения, в которых у марганца проявляются значения +2, +4, +6. Высшая степень окисления позволяет выступать соединениям в роли сильнейших окислителей. Например: KMnO 4 , Mn 2 O 7 .
Соединения с +2 являются восстановителями, гидроксид марганца (II) обладает амфотерными свойствами, с преобладанием основных. Промежуточные показатели степеней окисления образуют амфотерные соединения.
История открытия
Марганец - химический элемент, который был открыт не сразу, а постепенно и разными учеными. Однако его соединениями люди пользовались с древних времен. Оксид марганца (IV) применялся для выплавки стекла. Один итальянец констатировал тот факт, что добавка этого соединения при химическом производстве стекол окрашивает их цвет в фиолетовый. Наряду с этим, это же вещество помогает устранить мутность в цветных стеклах.
Позже в Австрии ученый Кайм сумел получил кусочек металлического марганца, воздействуя высокой температурой на пюролизит (оксид марганца (IV)), поташ и уголь. Однако данный образец имел много примесей, устранить которые ему не удалось, поэтому открытие не состоялось.
Еще позже другой ученый также синтезировал смесь, в которой значительная доля приходилась на чистый металл. Это был Бергман, до этого открывший элемент никель. Однако и ему довести дело до конца было не суждено.

Марганец - химический элемент, получить и выделить который в виде простого вещества впервые удалось Карлу Шееле в 1774 году. Однако сделал он это совместно с И. Ганом, который завершил процесс выплавки кусочка металла. Но даже им не удалось полностью избавить его от примесей и получить 100% выход продукта.
Тем не менее именно это время стало открытием данного атома. Эти же ученые предприняли попытку дать название, как первооткрыватели. Ими был выбран термин манганезиум. Однако после открытия магния началась путаница, и название марганца было изменено на современное (Х. Дэвид, 1908 год).
Так как марганец - химический элемент, свойства которого являются весьма ценными для многих металлургических процессов, со временем появилась необходимость все же найти способ получения его в максимально чистом виде. Данная проблема решалась учеными всего мира, но сумела разрешиться лишь в 1919 году благодаря работам Р. Агладзе - советского ученого-химика. Именно он нашел способ, которым можно из сульфатов и хлоридов марганца электролизным путем получить чистый металл с содержанием вещества 99,98%. Теперь этот метод применяется во всем мире.
Нахождение в природе
Марганец - химический элемент, фото простого вещества которого можно увидеть ниже. В природе существует масса изотопов этого атома, количество нейтронов в которых сильно колеблется. Так, массовые числа меняются в пределах от 44 до 69. Однако единственным стабильным изотопом является элемент со значением 55 Mn, все остальные имеют либо ничтожно короткий период полураспада, либо существует в слишком малых количествах.

Так как марганец - химический элемент, степень окисления которого весьма различна, то и соединений в природе он образует также много. В чистом виде данный элемент вообще не встречается. В минералах и рудах постоянный сосед его - железо. Всего можно обозначить несколько самых главных горных пород, в состав которых входит марганец.
- Пиролюзит. Формула соединения: MnO 2 *nH 2 O.
- Псиломелан, молекула MnO2*mMnO*nH2O.
- Манганит, формула MnO*OH.
- Браунит встречается реже, чем остальные. Формула Mn 2 O 3 .
- Гаусманит, формула Mn*Mn 2 O 4.
- Родонит Mn 2 (SiO 3) 2 .
- Карбонатные руды марганца.
- Малиновый шпат или родохрозит - MnCO 3 .
- Пурпурит - Mn 3 PO 4 .
Помимо этого, можно обозначить еще несколько минералов, в состав которых также входит рассматриваемый элемент. Это:
- кальцит;
- сидерит;
- глинистые минералы;
- халцедон;
- опал;
- песчано-алевритовые соединения.
Помимо горных и осадочных пород, минералов, марганец - химический элемент, который входит в состав следующих объектов:
- Растительные организмы. Самыми крупными накопителями этого элемента являются: водяной орех, ряска, диатомовые водоросли.
- Ржавчинные грибы.
- Некоторые виды бактерий.
- Следующие животные: рыжие муравьи, ракообразные, моллюски.
- Люди - суточная потребность примерно 3-5 мг.
- Воды Мирового океана содержат 0,3% этого элемента.
- Общее содержание в земной коре 0,1% по массе.
В целом это 14 по распространенности элемент из всех на нашей планете. Среди тяжелых металлов он второй после железа.
Физические свойства
С точки зрения свойств марганца, как простого вещества, можно выделить несколько основных физических характеристик для него.
- В виде простого вещества представляет собой достаточно твердый металл (по шкале Мооса показатель равен 4). Цвет - серебристо-белый, на воздухе покрывается защитной оксидной пленкой, на разрезе блестит.
- Температура плавления составляет 1246 0 С.
- Кипения - 2061 0 С.
- Проводниковые свойства хорошие, является парамагнетиком.
- Плотность металла составляет 7,44 г/см 3 .
- Существует в виде четырех полиморфных модификаций (α, β, γ, σ), различающихся строением и формой кристаллической решетки и плотностью упаковки атомов. Также отличается их температура плавления.
В металлургии применяются три основные формы марганца: β, γ, σ. Альфа реже, так как она слишком хрупкая по своим свойствам.

Химические свойства
С точки зрения химии, марганец - химический элемент, заряд иона которого сильно колеблется от +2 до +7. Это накладывает свой отпечаток и на его активность. В свободном виде на воздухе марганец очень слабо реагирует с водой, растворяется в разбавленных кислотах. Однако стоит лишь увеличить температуру, как активность металла резко возрастает.
Так, он способен взаимодействовать с:
- азотом;
- углеродом;
- галогенами;
- кремнием;
- фосфором;
- серой и прочими неметаллами.
При нагревании без доступа воздуха металл легко переходит в парообразное состояние. В зависимости от степени окисления, которую проявляет марганец, его соединения могут быть как восстановителями, так и окислителями. Некоторые проявляют амфотерные свойства. Так, основные характерны для соединений, в которых он +2. Амфотерные - +4, а кислотные и сильные окислительные в высшем значении +7.
Несмотря на то что марганец - это переходный металл, комплексные соединения для него немногочисленны. Это связано с устойчивой электронной конфигурацией атома, ведь 3d-подуровень его содержит 5 электронов.
Способы получения
Существует три основных способа, которыми в промышленности получают марганец (химический элемент). Как читается на латыни название, мы уже обозначали - manganum. Если перевести его на русский, то это будет "да, действительно проясняю, обесцвечиваю". Таким своим названием марганец обязан проявляемым свойствам, известным с самой древности.
Однако, несмотря на известность, получить его в чистом виде для применения сумели лишь в 1919 году. Делается это следующими методами.
- Электролизный, выход продукта составляет 99,98%. Таким способом получают марганец в химической промышленности.
- Силикотермический, или восстановление при помощи кремния. При данном методе происходит сплавление кремния и оксида марганца (IV), в результате чего формируется чистый металл. Выход составляет около 68%, так как побочно идет соединение марганца с кремнием в силицид. Данный способ применяют в металлургической промышленности.
- Алюминотермический метод - восстановление при помощи алюминия. Также не дает слишком высокого выхода продукта, марганец образуется загрязненный примесями.
Производство данного металла имеет важное значение для многих процессов, осуществляемых в металлургии. Даже небольшая добавка марганца способна сильно повлиять на свойства сплавов. Доказано, что в нем растворяются многие металлы, заполняя собой его кристаллическую решетку.

По добыче и производству данного элемента Россия занимает первое место в мире. Также этот процесс осуществляется в таких странах, как:
- Китай.
- Казахстан.
- Грузия.
- Украина.
Использование в промышленности
Марганец - химический элемент, применение которого важно не только в металлургии. но и в других областях. Помимо металла в чистом виде, большое значение имеют и различные соединения данного атома. Обозначим основные из них.
- Существует несколько видов сплавов, которые, благодаря марганцу, имеют уникальные свойства. Так, например, настолько прочная и износостойкая, что ее используют для выплавки деталей экскаваторов, камнеперерабатывающих машин, дробилок, шаровых мельниц, броневых деталей.
- Диоксид марганца - обязательный окислительный элемент гальваники, его используют при создании деполяризаторов.
- Многие соединения марганца нужны для осуществления органических синтезов различных веществ.
- Перманганат калия (или марганцовка) применяется в медицине в качестве сильного обеззараживающего средства.
- Данный элемент входит в состав бронзы, латуни, образует собственный сплав с медью, который служит для изготовления турбин самолетов, лопастей и прочих деталей.
Биологическая роль
Суточная потребность в марганце для человека составляет 3-5 мг. Дефицит данного элемента приводит к угнетению нервной системы, нарушению сна и беспокойству, головокружению. Роль его до конца еще не изучена, однако ясно, что, прежде всего, он оказывает влияние на:
- рост;
- деятельность половых желез;
- работу гормонов;
- образование крови.
Данный элемент присутствует во всех растениях, животных, человеке, что доказывает его немаловажную биологическую роль.

Марганец - химический элемент, интересные факты о котором могут произвести впечатление на любого человека, а также заставить понять, насколько он важен. Приведем самые основные из них, которые нашли свой отпечаток в истории данного металла.
- В тяжелые времена гражданской войны в СССР одним из первых экспортных продуктов была руда, содержащая большое количество марганца.
- Если диоксид марганца сплавить с и селитрой, а затем продукт растворить в воде, то начнутся удивительные превращения. Сначала раствор окрасится в зеленый цвет, затем окраска сменится на синий, после - фиолетовый. Наконец, станет малиновой и постепенно выпадет бурый осадок. Если же смесь встряхнуть, то снова восстановится зеленый цвет и все произойдет заново. Именно за это марганцовка и получила свое название, которое переводится, как "минеральный хамелеон".
- Если в землю вносить удобрения, содержащие марганец, то у растений повысится производительность и возрастет скорость фотосинтеза. Озимая пшеница будет лучше формировать зерна.
- Самая большая глыба минерала марганца родонита весила 47 тонн и была найдена на Урале.
- Существует тройной сплав, который называется манганин. Он состоит из таких элементов, как медь, марганец и никель. Его уникальность в том, что он обладает большим электрическим сопротивлением, которое не зависит от температуры, но находится под влиянием давления.
Конечно, это не все, что можно сказать об этом металле. Марганец - химический элемент, интересные факты о котором достаточно разнообразны. Особенно если говорить о тех свойствах, которыми он наделяет различные сплавы.
- Граница между европой и азией Америка относится к европе
- Как экономить деньги при маленькой зарплате?
- Порядок получения жилищной субсидии для военнослужащих
- Лимит кассы: нормативная база и сроки установления лимита
- Полная система вычетов Алгебраическая форма комплексного числа
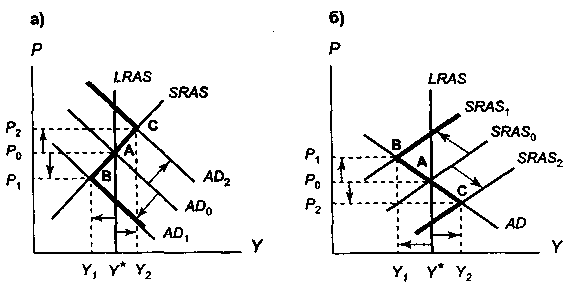
- Модель «Совокупный спрос – совокупное предложение Увеличение совокупного спроса вызывает
- Что называется периодом в физике
- Виды и типы недвижимости, их экономическая составляющая Поля инициализаторов типа
- Экономика, население и города Чеченской Республики
- Особенности проведения региональной программы материнский капитал в московской области Региональный материнский капитал программе семья
- Должностная инструкция страхового агента росгосстрах
- Учет материалов на складе и в бухгалтерии
- На вопрос «Можно ли строить дом без разрешения на строительство?
- Ип на осно какие налоги платит?
- Доходы и расходы будущих периодов Как распределить расходы, затрагивающие несколько налоговых периодов
- Экономические циклы, их особенности и виды
- Необходимо знать от чего зависят цены на жилье
- Контрольная работа: Экономическая мысль Древней Греции
- Бухгалтерские проводки по реализации товаров и услуг 1с бухгалтерия 8
- Оборотные активы организации